ГЛАВНЫЕ НОВОСТИ

Промоционная активность остаётся важнейшим инструментом взаимодействия фармацевтических компаний со специалистами здравоохранения. Она направлена на повышение осведомлённости врачей и фармацевтов о новых клинических данных, рекомендациях по применению препаратов, их преимуществах и возможностях использования. Это, в свою очередь, способствует назначениям и рекомендациям, а также укреплению лояльности к брендам. Сегодня фармкомпаниям доступен широкий спектр каналов коммуникации, включая как прямую, так и дистанционную коммуникацию, медиа, конференции и прочее. Оптимальное сочетание различных инструментов позволяет достигать высокой эффективности. В данной статье представлены ключевые тенденции промоционной активности и структуры назначений на фармацевтическом рынке Казахстана по итогам I кв. 2025 г. на основе данных PromoTest Kazakhstan и RxTest Kazakhstan компании «Proxima Research».
Данные RxTest и PromoTest Kazakhstan доступны в QlikView и Power BI, предоставляя расширенные аналитические возможности для эффективного управления показателями.
Инновационные решения в области анализа и визуализации предлагают гибкую аналитику, адаптированную под индивидуальные потребности, высокую скорость обработки данных и удобство использования, новый уровень аналитики с RxTest на Power BI.
Дополнительно пользователи могут самостоятельно настраивать разрезы аналитики, что делает систему интуитивно понятной, удобной и функциональной для решения стратегических и тактических задач.
Тенденции промоционной активности
По итогам I кв. количество воспоминаний специалистов здравоохранения (врачей и фармацевтов) обо всех видах промоции товаров «аптечной корзины» (лекарственные средства, медицинские изделия, диетические добавки и косметика) увеличилось на 6,5% по сравнению с аналогичным периодом предыдущего года и достигло 838,7 тыс. (рис. 1).
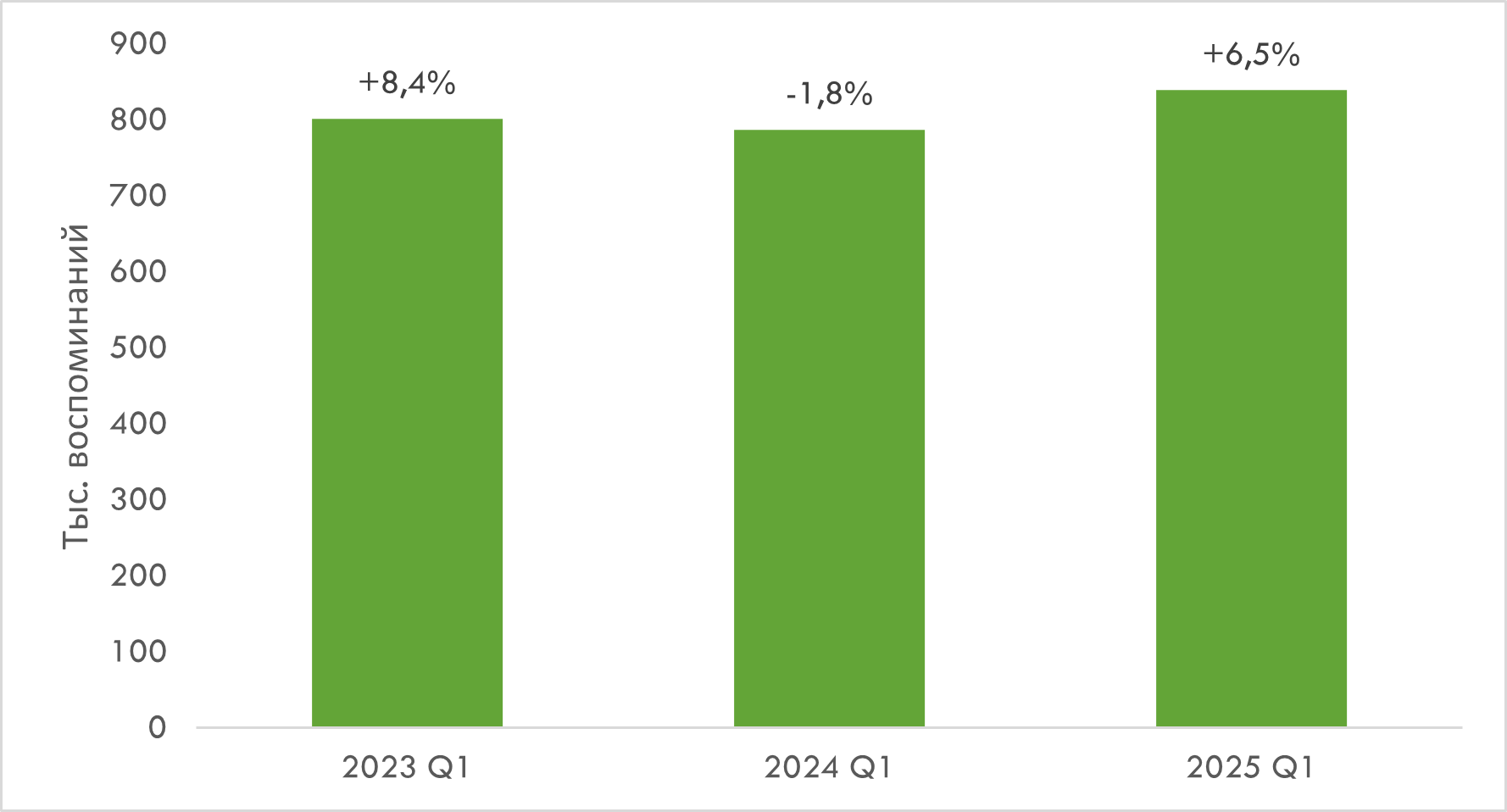
Рис. 1. Количество воспоминаний врачей и фармацевтов о различных видах промоции товаров «аптечной корзины» в I кв. 2023–2025 гг. с указанием темпов прироста/спада по сравнению с аналогичным периодом предыдущего года
Около 80% всей активности приходится на лекарственные средства. В исследуемый период количество воспоминаний о промоции лекарственных средств увеличилось на 4,6% (рис. 2). На втором месте по количеству воспоминаний – диетические добавки, демонстрирующие более высокие темпы прироста – на уровне 12,5%. Наиболее активный прирост демонстрируют медицинские изделия (+28,3%), однако их доля в общем объёме воспоминаний очень мала.

Рис. 2. Количество воспоминаний врачей и фармацевтов о промоции в разрезе товаров «аптечной корзины» по итогам I кв. 2025 г. с указанием темпов прироста/спада по сравнению с аналогичным периодом предыдущего года
В помесячной динамике наблюдается устойчивый рост воспоминаний о промоции с начала года с пиком в марте (рис. 3).
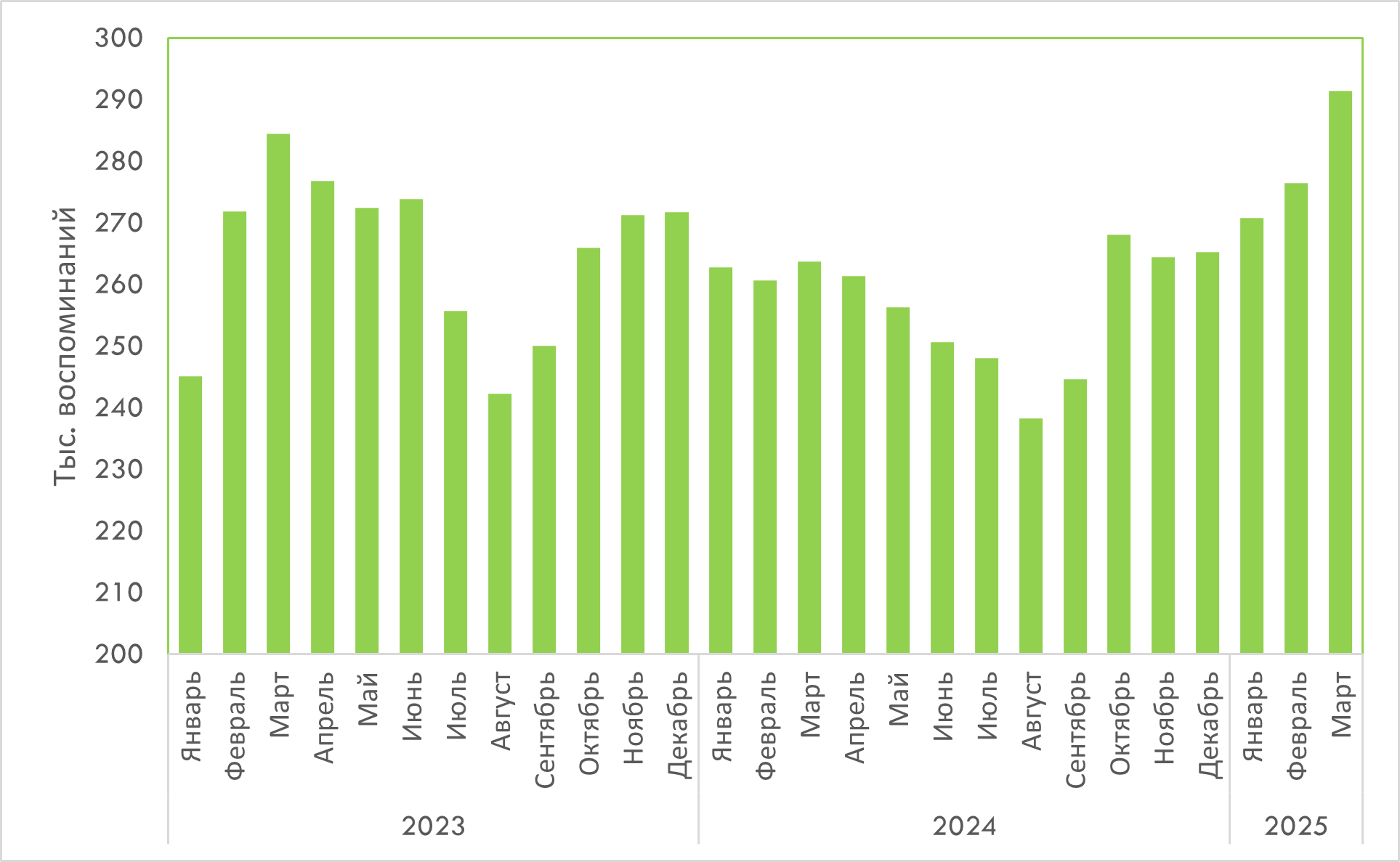
Рис. 3. Помесячная динамика количества воспоминаний врачей и фармацевтов о различных видах промоции товаров «аптечной корзины» с января 2023 по март 2025 г.
Зарубежные компании аккумулируют более 90% промоционной активности среди обеих аудиторий. В исследуемый период зафиксирован прирост воспоминаний о промоции как со стороны иностранных, так и отечественных игроков, причём последние демонстрируют более высокие темпы прироста (рис. 4).
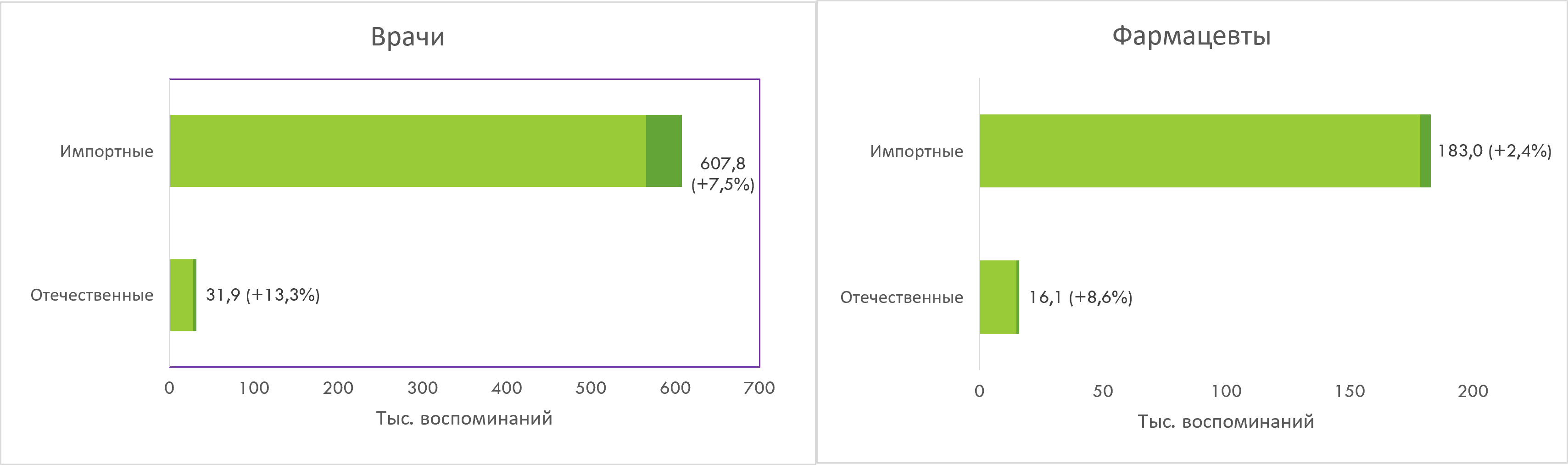
Рис. 4. Структура количества воспоминаний врачей и фармацевтов о различных видах промоции отечественных и зарубежных производителей товаров «аптечной корзины» по итогам I кв. 2025 г.
В разрезе каналов промоции лидирует прямая коммуникация, обеспечивая 48% воспоминаний среди врачей и 37% - среди фармацевтов. Вторым по значимости каналом для охвата врачей является удалённая коммуникация (рис. 5), тогда как у фармацевтов - POS-материалы (рис. 6). В аудитории фармацевтов важными каналами также является удалённая коммуникация, ТВ-реклама и акции. Среди врачей значимую долю воспоминаний занимает также ТВ-реклама и конференции.
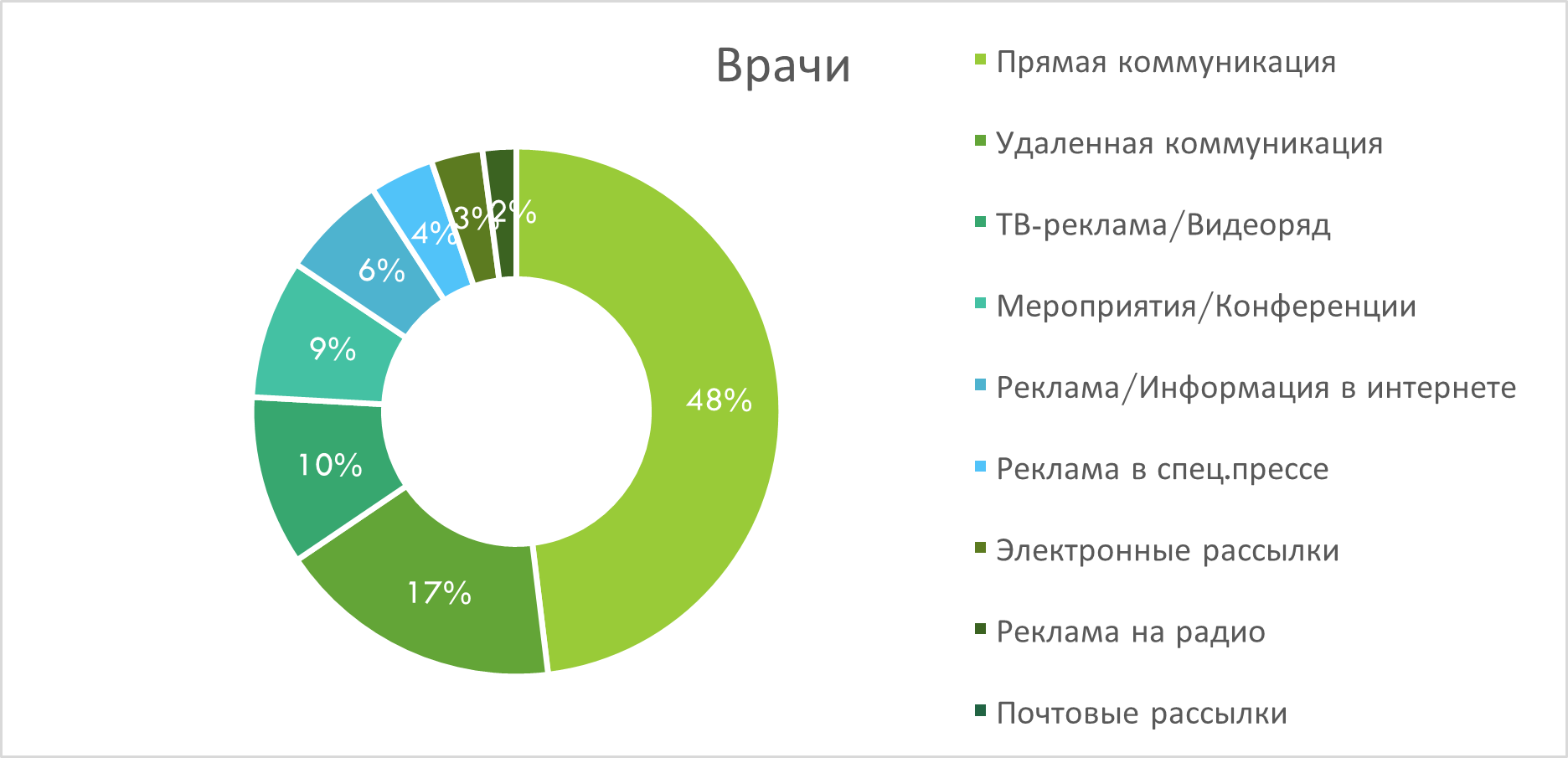
Рис. 5. Структура воспоминаний врачей о различных видах промоции лекарственных средств по итогам I кв. 2025 г.
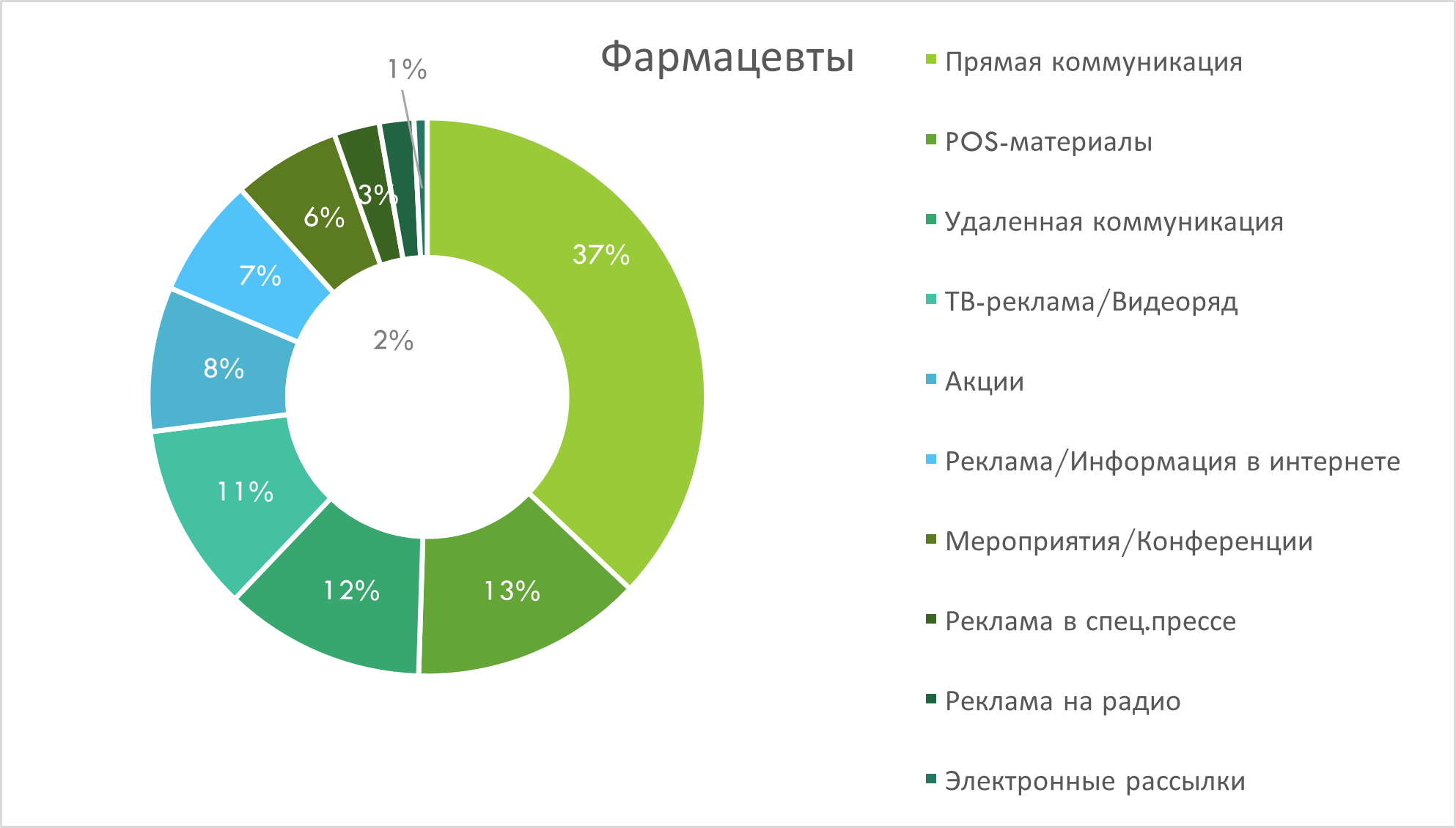
Рис. 6. Структура воспоминаний фармацевтов о различных видах промоции лекарственных средств по итогам I кв. 2025 г.
В исследуемый период зафиксировано увеличение промоактивности по большинству топ-10 наиболее охватываемых специальностей, за исключением педиатров, где отмечено снижение. Наибольший прирост продемонстрировал сегмент кардиологов (рис. 7).

Рис. 7. Структура воспоминаний специалистов здравоохранения о различных видах промоции лекарственных средств по итогам I кв. 2025 г. в разрезе топ-10 специальностей
Врачебные назначения
Основными специальностями по количеству назначений остаются терапевты/ врачи общей практики, гинекологи, педиатры, кардиологи и неврологи. В исследуемый период число назначений во всех этих аудиториях увеличилось (рис. 8).

Рис. 8. Структура назначений врачами топ-10 специальностей лекарственных средств по I кв. 2025 г.
Наибольшее количество назначений приходится на такие диагнозы как J00-J99 «Болезни органов дыхания», I00-I99 «Болезни системы кровообращения» и N00-N99 «Болезни мочеполовой системы». Для всех диагнозов из топ-10 зафиксирован рост количества назначений (рис. 9).

Рис. 9. Структура воспоминаний врачей о назначении лекарственных средств по итогам I кв. 2025 г. в разрезе класса МКБ-10
Ключевые игроки
В топ-3 фармкомпаний по количеству воспоминаний врачами о промоции по итогам I кв. 2025 г. вошли WORLD MEDICINE, Abbott Lab. и Santo. Среди фармацевтов лидируют Santo, Teva и ШТАДА-НИЖФАРМ (рис. 10).
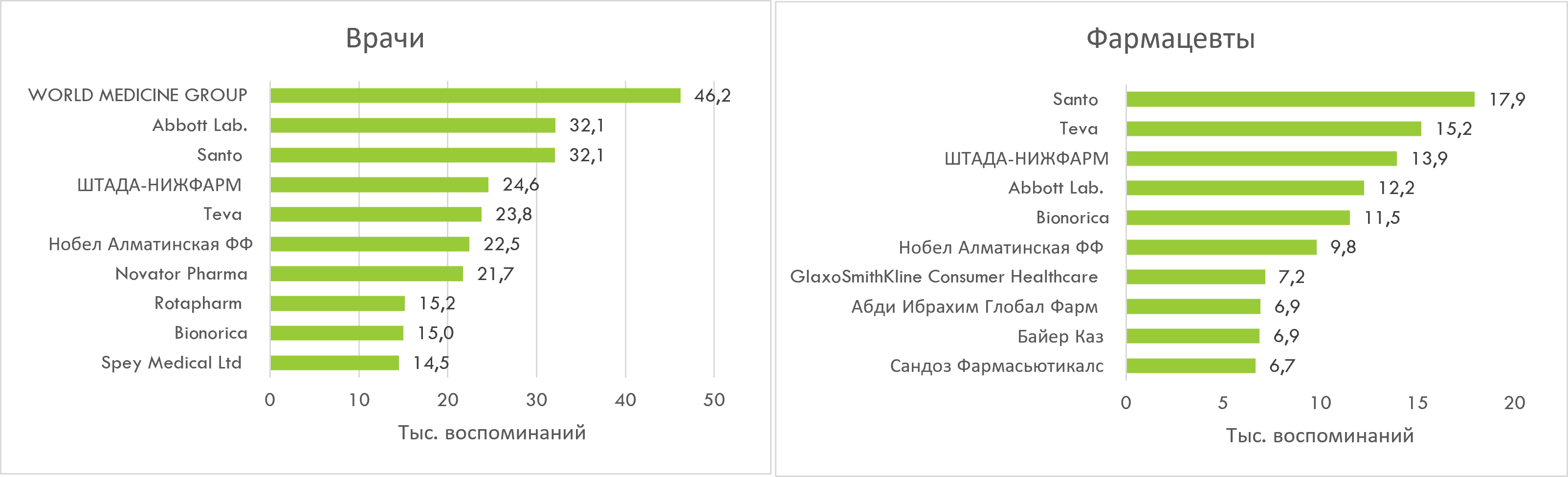
Рис. 10. Топ-10 маркетирующих организаций по количеству воспоминаний врачей и фармацевтов о различных видах промоции лекарственных средств по итогам I кв. 2025 г.
Среди брендов лекарственных средств, лидером по количеству воспоминаний как среди врачей, так и фармацевтов остается КРЕОН (рис. 11). Топ-3 дополняют у врачей ГЕПТРАЛ и АМБРОБЕНЕ, а у фармацевтов – ТАНФЛЕКС и АМБРОБЕНЕ.

Рис. 11. Топ-10 брендов лекарственных средств по количеству воспоминаний врачей и фармацевтов о различных видах промоции по итогам I кв. 2025 г.
По количеству врачебных назначений лидируют бренды лекарственных средств БИСОПРОЛОЛ, ПАРАЦЕТАМОЛ, ЦЕФ, КАНЕФРОН и КРЕОН (рис. 12).
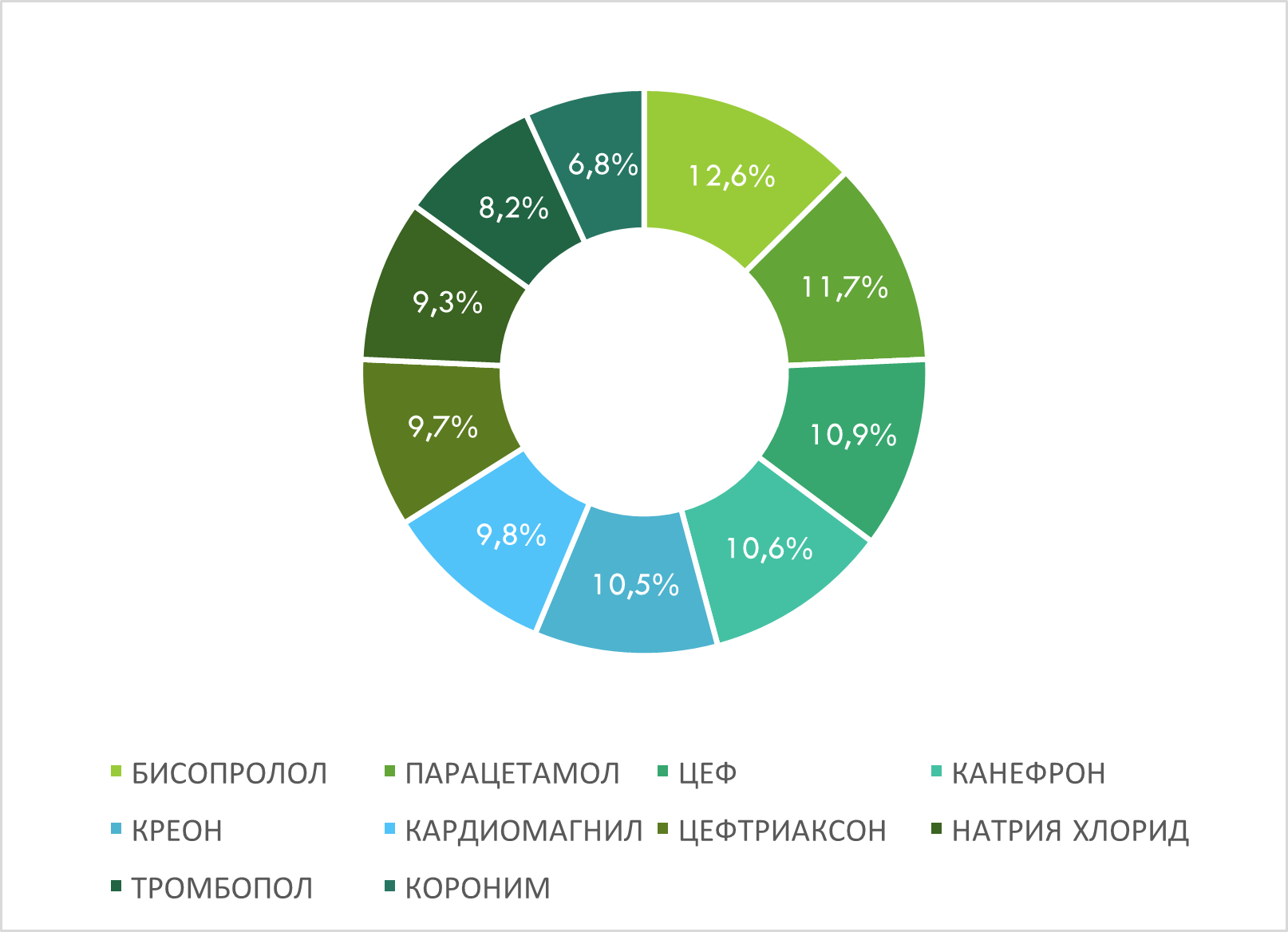
Рис. 12. Топ-10 брендов лекарственных средств по количеству врачебных назначений по итогам I кв. 2025 г. с указанием их доли в назначениях среди топ-10
Итоги
Данные I кв. 2025 г. свидетельствуют об умеренном, но устойчивом росте промоционной активности на фармацевтическом рынке Казахстана. Прямая коммуникация сохраняет основную долю воспоминаний о промоции. Удалённая коммуникация часто выступает дополнением и служит усилением эффективности промоции. Спектр используемых каналов коммуникации варьирует в зависимости от аудитории.
Основная доля усилий по-прежнему сосредоточена на лекарственных средствах, однако отмечается значительное оживление в сегменте диетических добавок и медицинских изделий.
Основную активность обеспечивают зарубежные компании. В то же время нельзя не отметить повышение активности отечественных производителей.
В разрезе аудиторий наблюдается спад активности в сегменте педиатров, тогда как в других аудиториях фиксируется рост. При этом количество врачебных назначений демонстрирует положительную динамику для основных прескрайберов и диагнозов.
Профессионалы компании «Proxima Research» всегда придут на помощь клиентам, проведут специализированные маркетинговые исследования любой сложности и окажут консультационные услуги. Помогут заглянуть в будущее фармацевтического рынка - по желанию заказчика сделают кратко-, средне- и долгосрочные прогнозы развития рыночной ситуации с учетом различных макроэкономических показателей. Благодаря такой поддержке фармкомпании смогут улучшать свои позиции на рынке, всегда владеть ситуацией и быть в тренде.
Контакты: https://proximaresearch.com/kz/ru/
E-mail:
Телефоны: +7 727 293 58 97, +7 727 293 58 96, +7 727 292 04 38
Facebook: https://www.facebook.com/PROXIMARESEARCH
Анонсы событий

РГП на ПХВ «Национальный научный центр развития здравоохранения имени Салидат Каирбековой» Министерства здравоохранения Республики Казахстан сообщает о проведении Республиканской научно-практической конференции, приуроченной к Международному дню семейного врача, на тему «Врач общей практики – лидер ПМСП», которая состоится 9-10 июня 2025 года на базе «Корпоративный фонд «Университетский медицинский центр» (г. Астана, ул. Керей и Жанибек Ханов, 5/1). Мероприятие пройдет в очном формате.
Официальными организаторами конференции выступают:
- Министерство здравоохранения Республики Казахстан;
- РГП на ПХВ «Национальный научный центр развития здравоохранения имени Салидат Каирбековой»;
- РГП на ПХВ «Республиканский центр первичной медико-санитарной помощи» Министерства здравоохранения РК.
При поддержке:
– Республиканского общественного объединения «Ассоциация организаторов в сфере охраны здоровья»;
– Объединения юридических лиц «Ассоциация развития и поддержки фармацевтических инноваций в здравоохранении (InnPharma)».
Программа конференции предусматривает рассмотрение следующих вопросов:
- актуальные аспекты организации деятельности врача общей практики, оптимизация нагрузки и рациональное использование ресурсов в системе ПМСП, внедрение программ управления заболеваниями и пересмотр клинических протоколов;
- применение инновационных методов и технологий в амбулаторной практике;
- участие социальных работников в системе здравоохранения и ПМСП.
Также будет проведена тематическая сессия по вопросам лекарственной политики, в рамках которой планируется рассмотреть:
– финансирование системы здравоохранения и лекарственного обеспечения в рамках ГОБМП и ОСМС;
– механизмы включения лекарственных средств в списки возмещения, реализация принципа «единого окна», оценка порога готовности платить, практика групповых закупок;
– организация персонифицированной заявочной кампании на 2026 год;
– актуальные изменения в законодательстве, включая положения, касающиеся порядка закупа лекарственных средств и изделий медицинского назначения.
Кроме того, в рамках конференции предусмотрен формат отдельных встреч для конструктивного обсуждения текущих вопросов между регуляторами здравоохранения и фармацевтического сектора.
Ожидается участие около 250 специалистов, включая представителей Министерства здравоохранения Республики Казахстан, подведомственных организаций, руководителей и сотрудников медицинских учреждений, врачей общей практики со всех регионов страны, представителей профессиональных объединений.
Официальные языки конференции: казахский, русский.
По всем вопросам обащайтесь в Ассоциацию развития и поддержки фармацевтических инноваций в здравоохранении (InnPharma).
E-mail:
Тел.:+77072441717 (whatsapp)
Исполнительный Директор Ассоциации - Эдем Османов.
С ПРОГРАММОЙ МЕРОПРИЯТИЯ МОЖНО ОЗНАКОМИТЬСЯ ПО СЛЕДУЮЩЕЙ ССЫЛКЕ: https://innpharma.kz/2025/05/13/attention_news_new_events/
События

Решением Совета Евразийской экономической комиссии от 14 мая 2025 года №29 внесены изменения в Решение Совета ЕЭК от 10 июня 2022 года №96 «О временных мерах по установлению особенностей обращения лекарственных средств для медицинского применения» в части продления срока установления уполномоченными органами государств-членов временного порядка обращения лекарственных средств, включая регистрацию лекарcтвенных препаратов и внесение изменений в регистрационное досье лекарственных препаратов, до 31 декабря 2027 года.
Поправки направлены на решение проблем возникновения дефектуры лекарственных средств, снижения уровня обеспечения лекарственной безопасности и возникновения перебоев с обеспечением обращения лекарственных средств в рамках ЕАЭС в условиях :
- военных действий для профилактики и лечения заболеваний и поражений, полученных в результате воздействия химических, биологических, радиационных факторов, разработанных по заданию уполномоченных в области безопасности и обороны органов государственной власти государств – членов ЕАЭС;
- угрозы возникновения или возникновения чрезвычайных ситуаций, для профилактики и лечения заболеваний и поражений, представляющих опасность для окружающих, полученных в результате воздействия химических, биологических, радиационных факторов.
Решение вступает в силу по истечении 10 календарных дней с даты его официального опубликования и распространяется на правоотношения, возникшие с 1 января 2025 года.

В трех крупных городах Казахстана: Астана, Алматы и Шымкент прошла серия научно-практических конференций «НовоФорум Ново Нордиск: современные тренды и инновационные перспективы», организованная при поддержке РОО «Ассоциация врачей-эндокринологов Казахстана» (РОО АВЭК) в Алматы и Шымкенте и ОО Общество эндокринологов г. Астана в Астане. Конференции собрали более 520 врачей-эндокринологов и кардиологов со всего Казахстана, обсудив с ключевыми лидерами эндокринологического сообщества актуальные вопросы менеджмента сахарного диабета 2 типа.
Данные конференции, как и все предыдущие, имели строго образовательную направленность - повышение уровня информированности специалистов в вопросах диагностики и лечения сахарного диабета.
Согласно данным Министерства здравоохранения РК, на 1 января 2025 года более полумиллиона казахстанцев живут с этим заболеванием.1 Однако реальная распространенность заболевания превышает официальные данные в 3-4 раза, о чем свидетельствуют результаты исследования NOMAD, проведенного РОО АВЭК в 2017 г.2
Болезнь приводит к тяжелым осложнениям, инвалидности и высокой смертности, создавая серьезную нагрузку на систему здравоохранения. Какие современные методы профилактики и лечения могут помочь изменить ситуацию? Эти вопросы стали ключевой темой данной конференции.
Сахарный диабет - вызов для медицины и общества
Как отметили организаторы конференции, сахарный диабет остается одной из самых острых медико-социальных проблем в Казахстане, затрагивая жизни сотен тысяч граждан. В связи с этим одной из ключевых задач медицинского форума стало создание платформы для обмена знаниями и обсуждения последних обновлений в области эндокринологии.
“Сегодня сахарный диабет — это не только медицинская проблема, но и вызов для всей системы здравоохранения. Нам важно не просто лечить болезнь, а работать над ее предотвращением, развивая профилактические программы и современные методы терапии”, - отметила доцент кафедры гастроэнтерологии НАО КазНМУ им. С. Д. Асфендиярова, главный врач Interna Clinic, к.м.н. Раисова Айгуль Муратовна.
Правда и мифы о семаглутиде: что говорят эксперты?
В центре внимания серии образовательных мероприятий был инновационный препарат семаглутид (торговое наименование, зарегистрированное в Республике Казахстан - Оземпик®3) по многочисленным запросам практикующих эндокринологов, кардиологов и врачей общей практики.
Данный препарат показан для терапии сахарного диабета 2 типа и зарегистрирован в Казахстане в 2 формах выпуска:
- Оземпик® Раствор для подкожного введения, 1,34 мг/мл, 1 мг/доза + 4 одноразовых игл НовоФайн Плюс от 04.09.2020;
- Оземпик® Раствор для подкожного введения, 1,34 мг/мл, 0,25 или 0,5 мг/доза + 6 одноразовых игл НовоФайн Плюс от 17.09.2020;
На фоне растущего интереса к препарату в обществе появилось много мифов и недостоверной информации, в том числе касающейся возможных нежелательных явлений. Чтобы развеять заблуждения, эксперты представили ключевые медицинские исследования, подтверждающие эффективность и безопасность семаглутида при соблюдении условий транспортировки, хранения, инструкции по его применению и должном врачебном контроле. Они подчеркнули, что препарат является частью комплексного подхода к лечению диабета, основанного на доказательной медицине и включен в рекомендации по лечению сахарного диабета эндокринологических и кардиологических профессиональных сообществ Европы и клинические протоколы Республики Казахстан.
Важно подчеркнуть, что лишь зарегистрированные препараты имеют официальное подтверждение безопасности и эффективности, и их следует приобретать исключительно в лицензированных аптеках. Общественность должна быть проинформирована о том, что только покупка в официальных аптеках гарантирует получение качественного и эффективного продукта, а также минимизирует риски, связанные со здоровьем.
Также на сессии обсудили важность своевременного сообщения о нежелательных явлениях на лекарственные препараты. Это не только помогает снизить возможные риски для пациентов, но и повышает общий уровень безопасности лекарственных препаратов.
«В эпоху цифровых технологий, когда информация распространяется очень быстро, важно, чтобы пациенты и врачи опирались не на слухи, а были осведомлены о научных данных, касающихся любых лекарственных препаратов. Образовательные инициативы, подобные этой, помогают укрепить доверие к медицине и повысить уровень знаний о правильном лечении диабета», - отметила доцент кафедры внутренних болезней с курсом нефрологии, гематологии, аллергологии, иммунологии НАО «Медицинский университет Астана» к.м.н. Базарова Анна Викентьевна.
Судя по отзывам, НовоФорум имел большой успех у участников, став важной платформой для обмена знаниями и лучшими практиками. Слушатели смогли обогатить свои знания и поделиться опытом, что в итоге, несомненно, позволит повысить качество жизни пациентов и укрепить систему здравоохранения в целом.
Ссылки:
- Доклад главного внештатного эндокринолога Даньяровой Л.Б. 15.03.25
- УДК 616.379-008.64-053.8(574)
Н.Н. Токтарова1, Р.Б. Базарбекова2, А.К. Досанова2
1АО «Национальный научный медицинский центр», г. Астана, Республика Казахстан,
2Казахский медицинский университет непрерывного образования, г. Алматы, Республика Казахстан,
РАСПРОСТРАНЕННОСТЬ САХАРНОГО ДИАБЕТА 2 ТИПА СРЕДИ ВЗРОСЛОГО НАСЕЛЕНИЯ КАЗАХСТАНА (РЕЗУЛЬТАТЫ РЕГИСТРОВОГО НАЦИОНАЛЬНОГО ИССЛЕДОВАНИЯ NOMAD) - В государственном реестре лекарственных средств Казахстана зарегистрирован препарат с международным непатентованным названием «Семаглутид», код АТХ A10BJ06: Оземпик®, производитель Novo Nordisk A/S, Дания: раствор для подкожного введения 1,34 мг/мл (шприц-ручка 0,25 мг или 0,5 мг/доза), №РУ РК-ЛС-5№024745; раствор для подкожного введения 1,34 мг/мл (шприц-ручка 1 мг/доза), №РУ РК-ЛС-5№024719; http://register.ndda.kz/category/search_prep.
Аналитика

Согласно данным Sell Out аналитической системы маркетинговых исследований «PharmXplorer» компании Proxima Research International, в I кв. 2025 г. суммарный объем розничного и госпитального рынка лекарственных средств Республики Казахстан в стоимостном выражении составил 295 млрд тенге ($580 млн), что на 14,5% (в $ 1,2%) больше, чем в аналогичном периоде предыдущего года. В натуральном выражении объем рынка уменьшился на 9,2% до 136 млн упаковок.
Основная часть потребления, как в упаковках, так и в денежном выражении, приходится на розничный сегмент - в I кв. в 2025 г. через аптеки Казахстана было продано 118,1 млн упаковок на 184,2 млрд тенге. Общий объем аптечных продаж всех товаров «аптечной корзины» за исследуемый период составил 238,2 млрд тенге за 189,2 млн упаковок.
Более 70% аптечных продаж в денежном выражении приходится на препараты стоимостью от 1 до 10 тыс. тенге. В натуральном выражении почти половину продаж (44%) обеспечивают лекарственные средства стоимостью 100–500 тенге, а еще четверть (26%) - препараты в ценовом диапазоне от 1 до 3 тыс. тенге.
Крупнейшей аптечной сетью в Республике Казахстан остается «Биосфера», владеющая по состоянию на март 2025 г. 448 аптеками по стране (рис. 1). На втором месте — сеть, принадлежащая «Зерде-фарма», с более чем 344 аптеками. Замыкает тройку лидеров «Рауза-Аде», насчитывающая 190 торговых точек.
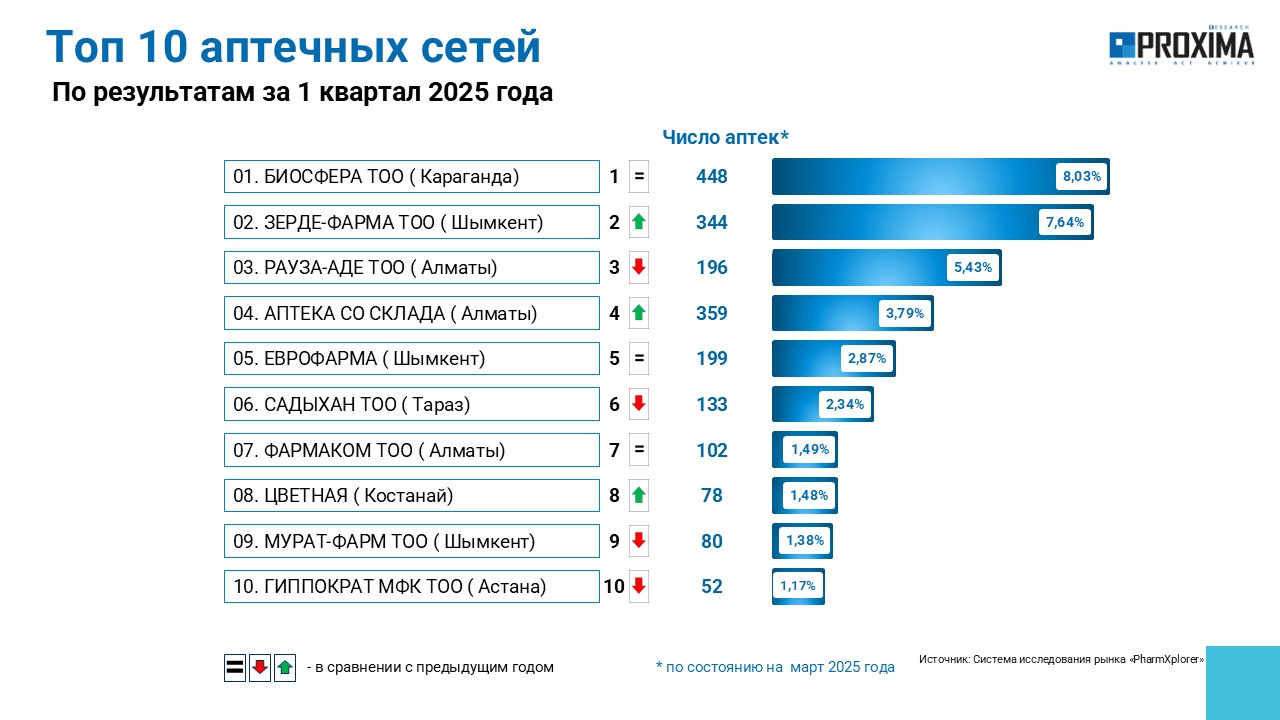
Рис. 1. Топ-10 аптечных сетей по количеству аптек по состоянию на март 2025 г. Республики Казахстан.
Львиную долю общего товарооборота — 72% — аккумулируют сетевые аптеки, тогда как индивидуальные обеспечивают оставшиеся 28% (рис. 2). Максимальная доля сетевых аптек зафиксирована в Туркестанской области (98%), а наибольший удельный вес индивидуальных аптек отмечен в Улытауской области (45%). Наибольшее количество как сетевых, так и индивидуальных аптек сосредоточено в крупнейшем городе Республики Казахстан — Алматы. На втором месте находится столица Астана.
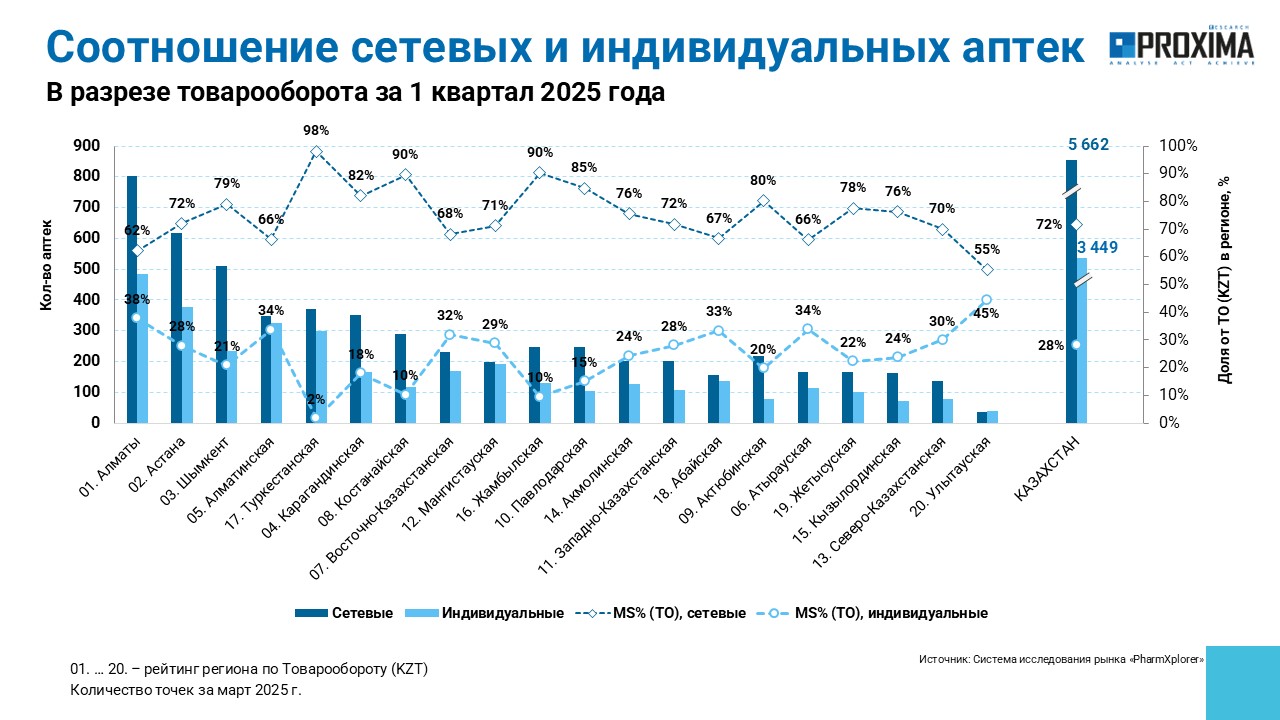
Рис. 2. Структура товарооборота в разрезе сетевых и индивидуальных аптек в Республике Казахстан по итогам I кв. 2025 г. в целом по стране и по областям.
В Алматы по состоянию на март 2025 г. работает 1,3 тыс. аптек, а их среднемесячный товарооборот по итогам I кв. 2025 г. составляет 23,7 млрд тенге (рис. 3). В Астане насчитывается почти 1 тыс. аптек, со среднемесячным товарооборотом на уровне 9 млрд тенге.
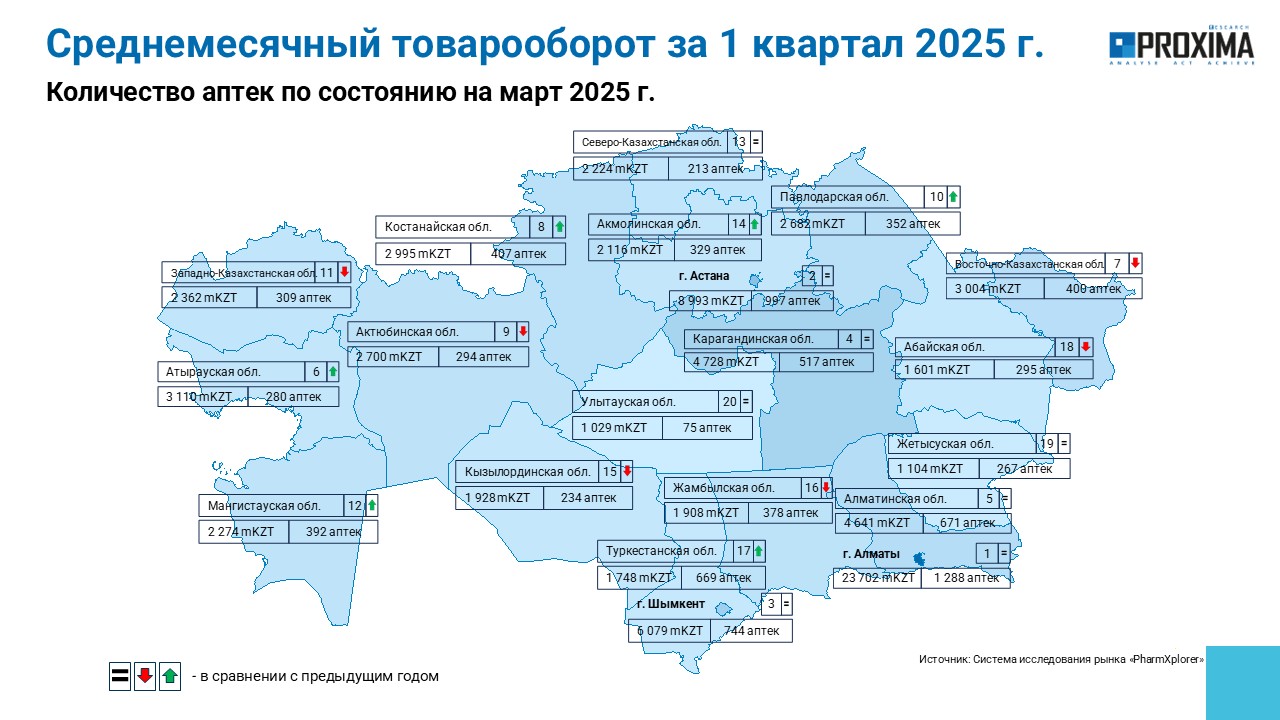
Рис. 3. Количество аптек в Республике Казахстан по состоянию на март 2025 г. в разрезе регионов с указанием среднемесячного товарооборота за I кв. 2025 г.
Профессионалы компании «Proxima Research» всегда придут на помощь клиентам, проведут специализированные маркетинговые исследования любой сложности и окажут консультационные услуги. Помогут заглянуть в будущее фармацевтического рынка - по желанию заказчика сделают кратко-, средне- и долгосрочные прогнозы развития рыночной ситуации с учетом различных макроэкономических показателей. Благодаря такой поддержке фармкомпании смогут улучшать свои позиции на рынке, всегда владеть ситуацией и быть в тренде.
Контакты: https://proximaresearch.com/kz/ru/
E-mail:
Телефоны: +7 727 293 58 97, +7 727 293 58 96, +7 727 292 04 38
Facebook: https://www.facebook.com/PROXIMARESEARCH

С 29 по 30 октября 2025 года в Астане, выставочный центр «EXPO», состоится Международная выставка «United Medical Expo» — масштабное деловое событие, объединяющее ключевых игроков медицинской и фармацевтической отрасли изКазахстана и 15 стран мира.
Продемонстрируйте свою продукцию мировой аудитории! Заполните форму на официальном веб-сайте, чтобы подтвердить свое участие.
Посетите выставку бесплатно в качестве посетителя — зарегистрируйтесь по ссылке.
Разделы выставки:
- Медицинское оборудование и технологии
- Медицинский туризм
- Фармацевтика и медицинская промышленность
- Фармакология
- Эстетическая медицина и косметология
- Стоматология, стоматологическое оборудование и материалы
Новейшую продукцию и услуги представят более 300 компаний из 15 стран, включая: Беларусь, Германию, Индию, Казахстан, Китай, Республику Корея, Кубу, Кувейт, Ливан, Россию, Сингапур, Турцию, Таиланд, Хорватию и Японию.
Особый интерес вызовут национальные экспозиции Китая и Кубы, участники которых продемонстрируют собственные разработки и передовые медицинские технологии.
5 причин принять участие в выставке:
1. Увеличить объемы продаж и расширить географию сбыта
2. Найти новых поставщиков и производителей
3. Установить новые и поддержать существующие деловые контакты
4. Обеспечить эффективное продвижение, рекламу и PR своей компании
5. Получить актуальную информацию о новинках рынка и международных трендах
«United Medical Expo» — это профессиональная платформа для налаживания деловых связей, обмена опытом и презентации инновационных решений в области медицины.
Нажмите сюда для гарантированного стенда!
Для получения более подробной информации о выставке, пожалуйста, свяжитесь с нами по телефону WhatsApp: +905368106898
Анонсы событий

С 21 по 23 мая 2025 года всё медицинское и фармацевтическое сообщество соберется на 30-й Юбилейной Казахстанской Международной выставке «Здравоохранение» - KIHE 2025 и 2-й Казахстанской международной выставке «Оборудование, сырье и технологии для фармацевтической промышленности» - PharmaTECH Kazakhstan 2025, которые пройдут в 9, 10 и 11 павильонах КЦДС «Атакент».
Передовые достижения и инновационные разработки в области медицины и фармацевтики презентуют на своих стендых свыше 380 компаний из Беларуси, Великобритании, Германии, Египта, Индии, Италии, Казахстана, Китая, Пакистана, Польши, России, Сингапура, Турции, Украины и Узбекистана. Производители и дистрибьюторы из Германии, Китая и Узбекистана примут участие в составе Национальных стендов, а экспортные центры России и Беларуси представят коллективные экспозиции. Рост интереса к развитию отрасли отражается в постоянно расширяющемся списке участников выставки: к ежегодным экспонентам присоединяются новые компании, впервые представляющие свою продукцию на площадке выставок.
В течение всех трёх дней работы KIHE 2025 и PharmaTECH Kazakhstan 2025 участников ожидает насыщенная деловая программа, охватывающая ключевые вопросы развития медицинской и фармацевтической отраслей. Параллельно в трёх конференционных залах пройдут пленарные сессии, панельные дискуссии, презентации новых технологий и оборудования, мастер-классы и обучающие семинары.
21 мая свою работу начнет Kazakhstan MedInvest Forum — ключевое событие для обсуждения инвестиций и развития партнерств в сфере здравоохранения. Форум откроет пленарная сессия «Капитал здоровья Казахстана: инвестиции, партнерства, инновации», в рамках которой эксперты рассмотрят источники инвестиций, инвестиционный климат, интеграцию в ЕАЭС, практические аспекты привлечения средств и перспективы развития «умных» инвестиций.
Программу продолжит панельная дискуссия «Инфраструктура здоровья: партнерства и решения» о роли государственно-частного партнерства в развитии медицинской инфраструктуры, а также сессия «Развитие медицинского туризма: горизонты Центральной Азии», где будет обсуждаться потенциал Казахстана как центра медицинского туризма региона. В этот день также пройдут панельная дискуссия от компании Medstandard сучастием международных экспертов «Современные тенденции в регистрации: взгляд экспертов из Казахстана, Узбекистана, Кыргызстана, Азербайджана и роль бизнеса в этом процессе», конференция Казахского общества анестезиологов и реаниматологов, а также серия практических семинаров от компаний ДНК-Технология, Виста Мед, Grand Lens Nova, АЛЬФАЛАБ НИОКР, KAZANADA и 103.kz.
22 мая программа выставок KIHE 2025 и PharmaTECH Kazakhstan 2025 продолжится насыщенным циклом мероприятий, особое внимание в этот день будет уделено вопросам развития фармацевтической отрасли. Ключевым событием станет пленарная сессия «Фармацевтическая отрасль Республики Казахстан: реалии и перспективы развития», за которой последуют специализированные сессии, посвящённые вопросам лекарственного обеспечения, регулирования лекарственных средств и медицинских изделий, а также внедрению системы маркировки лекарств. Параллельно во втором конференционном зале пройдут Стратегическая сессия «Тарифная политика ОСМС», Конференция руководителей организаций здравоохранения, а также панельная дискуссия на тему «Страхование: риски и синергия систем». В течение дня будут организованы практические семинары от ведущих компаний ITCO MED, STERIMED, 4clinic, Asia Medical Partners, ZYBIO Inc. и WELLGO, на которых участники смогут получить прикладные знания и познакомиться с последними технологическими решениями.
23 мая, в заключительный день работы выставок, программа продолжит свою практическую направленность. Участников ожидают семинары от компаний NASCO Healthcare Inc., МедРокет и Лаборфарма, посвящённые современным технологиям в медицине, работе с пациентским опытом и решениям для лабораторной диагностики.
Проведение масштабной деловой программы в рамках KIHE 2025 и PharmaTECH Kazakhstan 2025 подчеркивает важную роль выставок как стратегической площадки для развития медицины и фармацевтики. Синергия двух отраслей в рамках одного события создает уникальные условия для обмена знаниями, демонстрации инноваций и построения эффективных партнёрств. Объединяя производителей, дистрибьюторов, представителей науки, медицины и фармацевтического бизнеса, выставки способствуют укреплению профессионального сообщества, ускорению внедрения новых технологий и модернизации систем здравоохранения в Казахстане и Центральной Азии.
Всего в деловой программе в рамках выставок заявлено более 80-ти спикеров, среди которых представители Министерства здравоохранения РК, Акимата города Алматы, городских и областных Управлений здравоохранения, отраслевых ассоциаций, фондов развития, инвестиционных, страховых, IT компаний, а также руководство медицинских центров, клинических больниц, фармацевтических, производственных и торговых компаний.
Партнером регистрации выставки KIHE этого года выступает компания «MEDIKER», которая предлагает своим клиентам высокопрофессиональное медицинское обслуживание и отличный сервис. MEDIKER — крупнейшая частная медицинская компания Казахстана с 25-летним опытом динамичного и устойчивого развития. Разветвлённая сеть собственных медицинских центров, охватывающих все регионы страны, сертифицирована в рамках Национальной системы аккредитации. Компания зарекомендовала себя надежным партнером с безупречной деловой репутацией и признанным лидером в области медицинского ассистанса и промышленной медицины.
Стратегический партнер деловой программы - ОЮЛИП в ФА «Ассоциация аналитиков здравоохранения». Генеральный ТВ-Медиа Партнер - телеканал 1MEDTV Kазахстан.
Второй год подряд во время выставочных мероприятий будет вести работу медиа-корнер, где Первый Медицинский ТВ-канал 1MEDTV.KZ Казахстан в режиме реального времени будет освещать ключевые события выставок и деловой программы, проводить эфиры, интервью и Expert Talks. В качестве экспертов приглашены ведущие представители медицинского сообщества Казахстана, власти и бизнеса.
Официальная поддержка: Министерство здравоохранения РК, Акимат Алматы, Управление общественного здоровья Алматы, ТОО «СК-Фармация», Ассоциация международных фармацевтических производителей в РК, ОЮЛ «Ассоциация медицинского туризма города Алматы», Евразийская Медицинская Ассоциация, Ассоциация поддержки и развития фармацевтической деятельности РК, КОАР ОО «Казахское общество анестезиологов и реаниматологов», Казахское общество нейромодуляции, Ассоциация Менеджеров Здравоохранения РК и др.
Организатором выставки выступает Казахстанская выставочная компания ITECA и её международный партнёр Группа компаний ICA Events.
Более подробную информацию можно получить на сайте: www.kihe.kz
Получить билет на выставку и доступ на посещение Деловой программы можно по ссылке с промокодом: https://kihe.kz/ru/posetitelyam/poluchite-bilet-na-vystavku?promo=KIHE25ANN.

Управление США по контролю за пищевыми продуктами и лекарственными средствами (FDA) планирует изучить влияние фтора, который входит в состав рецептурных лекарственных препаратов, на организм детей, а затем, по результатам данного анализа предпринять соответствующие меры, вплоть до полного их изъятия с рынка.
Как сообщается на официальном информационном ресурсе FDA, в отличие от зубной пасты и ополаскивателей для рта со фтором, лекарства проглатываются и данный элемент попадает в организм младенцев и детей младшего возраста. Между тем, имеются научные исследования, которые показывают, что фториды могут не только оказывать нейротоксический эффект, но и изменить микробиом кишечника, а также стать причиной заболеваний щитовидной железы, набора веса и, возможно, снижения IQ (1, 2, 3, 4, 5).
В этой связи Комиссар FDA Марти Макари, доктор медицины, магистр общественного здравоохранения, поручил Центру оценки и исследований лекарственных средств до 31 октября 2025 года провести оценку доказательств относительно рисков системного воздействия фторида, находящегося в составе одобренных FDA детских рецептурных лекарственных препаратов. по итогам которой будут приняты меры по их отзыву с рынка.
Министерство здравоохранения и социальных служб США планирует распространить лучшие практики гигиены полости рта у детей, которые являются осуществимыми, эффективными и не влияют на здоровье кишечника.
Напомним, в настоящее время фторид не добавляется в питьевую воду в большинстве стран Европы и мира. Что же касается США, то ранее несколько штатов уже предприняли действия по прекращению фторирования питьевой воды.
Ссылки на источники исследований:
- Does fluoride exposure impact on the human microbiome? - PubMed
- Effect of Fluoride on Gut Microbiota: A Systematic Review | Nutrition Reviews | Oxford AcademicExternal Link Disclaimer
- Fluoride Exposure and Children’s IQ Scores: A Systematic Review and Meta-AnalysisExternal Link Disclaimer
- Does fluoride exposure affect thyroid function? A systematic review and dose-response meta-analysis
- Water fluoridation for the prevention of dental caries - Iheozor-Ejiofor, Z - 2024 | Cochrane Library
Программа автоматизации для аптек Казахстана
Новости
Асхат Аймагамбетов: Надо ли упростить допуск лекарств, одобренных FDA и EMA, на рынок Казахстана?
Проект Налогового кодекса одобрен Мажилисом. Обзор изменений для фармсектора и медицины
FDA одобрена первая генно-клеточная терапия для лечения буллёзного эпидермолиза

В Казахстане расширят базу медорганизаций, проводящих операции по трансплантации роговицы

Мажилисом Парламента РК во втором чтении одобрен проект закона по вопросам ОСМС

В ТОО «СК-Фармация» состоялась встреча с российскими производителями медоборудования

Американская академия педиатрии обновила рекомендации по лечению атопического дерматита

Программы поддержки фармацевтической отрасли Индии демонстрирует хорошую эффективность
Статьи
В ЕАЭС продлен временный порядок обращения лекарст...
Сахарный диабет - реальная угроза для казахстанцев...

FDA планирует изъять с рынка рецептурные лекарстве...

Конференция в Акмолинской области: фокус на социал...
В Алматы прошли уникальные высокотехнологичные опе...

В РК начинается пилотный проект по регистрации ЛС ...

Фармацевтический рынок Казахстана: вызовы и риски ...

Казахстан упрощает регистрацию и обращение лекарст...

SANTO Member of Polpharma Group получила сертифика...

В Правительстве РК прошло заседание по вопросам ра...
Аналитика

Промоция и назначения на фармацевтическом рынке Ка...

Аптеки Казахстана: количество по регионам, лидеры,...

Фармацевтический рынок Республики Казахстан: обзор...

Медицинский представитель - работа мечты или време...
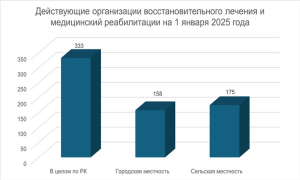
В Казахстане функционирует 333 санаторно-курортных...

Промоция и назначения на фармацевтическом рынке Ка...
Сколько казахстанцы тратят на платные медицинские ...

В Казахстане сетевые аптеки аккумулируют львиную д...

Фармацевтический рынок Республики Казахстан: обзор...

 English
English العربية
العربية 简体中文
简体中文 Français
Français Русский
Русский Español
Español Қазақ тілі
Қазақ тілі





















