Более того, анализ продаж показал, что в Казахстане только эти 8 препаратов продавались в 2015 году по данным IMS Health на общую сумму 14,7 млрд тенге, что составляет более 4% от всего объема фармацевтического рынка (рис. 1). В свете появления биосимиляров интерес к данному вопросу только усиливается.
Рисунок 1. Объемы реализации ТОП-8 биотехнологических ЛС в мире и в РК, 2015 год

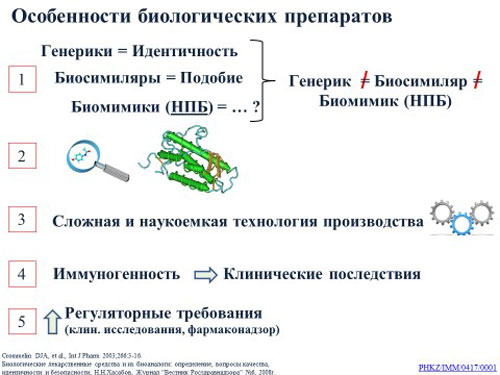
Особенности биологических препаратов
Первая особенность – понятийный аппарат. Генерики и биосимиляры уже давно знакомые нам всем понятия, определения которых есть в нормативных актах, регулирующих сферу здравоохранения. Биосимиляр – биотехнологический лекарственный препарат, подобный с произведенным впервые (оригинальным) лекарственным препаратом по качеству, безопасности, эффективности. Генерик – лекарственный препарат, идентичный оригинальному лекарственному средству по составу активных субстанций, лекарственной форме, показателям качества, безопасности, эффективности. Ключевое, что необходимо подчеркнуть: в определении генериков присутствует слово «идентичность», в определении биосимиляров – «подобие», а это уже разные понятия.
Но в нашем законодательстве, как и во многих других, пока нет нового понятия, которое уже встречается в рецензируемых научных изданиях и документах стран с высокой степенью регулирования рынка биологических ЛС – биомимики или несопоставимые биологические препараты. Термин относительно новый как в мире (2-3 года), так и в РК. Биомимики – это биологические препараты, выведенные на рынок до внедрения научно-обоснованных регуляторных подходов к регистрации биосимиляров. Препараты, не имеющие надежных данных клинических исследований, доказывающих высокую степень подобия с референтным препаратом.
Важно отметить, что нельзя ставить знак равенства между генериками, биосимилярами, биомимиками, т.к. это разные понятия и регуляторные требования к ним должны быть разные.
Вторая особенность – сложная пространственная структура БП и высокий молекулярный вес. Чем больше масса и пространственная структура, тем сложнее сделать подобный препарат и существенна разница в составе и количестве гликоформ.
Третья особенность – биотехнологическое производство представляет собой крайне сложный, многоэтапный процесс, включающий в себя синтез кодирующей ДНК действующего вещества; подбор вектора и встраивание ДНК в геном клетки-«хозяина»; скрининг и экспрессию рекомбинантных клеток; культивирование; выделение и очищение препарата; создание лекарственной формы. Генерики же создаются методом органического синтеза. Даже незначительные изменения в процессе производства могут привести к непредсказуемым последствиям. Каждый этап сложного процесса производства наделяет уникальными свойствами конечный биологический препарат.
Четвертая особенность, связанная со сложностью производства – это иммуногенность. Различия в производственном процессе и микрогетерогенность молекулы биоподобного препарата могут привести к тому, что оригинальный биотехнологический продукт и биоподобный препарат могут вызывать в организме человека разные иммунные реакции, которые могут быть не зафиксированы в регистрационных клинических исследованиях. Доказано, что это может привести к формированию антилекарственных антител, т.е. иммуногенности.
Иммуногенность одна из наиболее серьезных проблем не только безопасности терапии биосимилярами, но и ее эффективности. Данные, полученные по иммуногенности биологических препаратов, очень сильно зависят от чувствительности и специфичности метода, которым определялись антитела. Один из методов оценки иммуногенности – мониторинг безопасности лекарственных средств после их одобрения. Т.е. переходим к следующей пятой особенности – к БП применяются более строгие регуляторные требования и требования фармаконадзора (рис. 2).
Рисунок 2. Особенности биологических препаратов
Так, на сайте крупного южнокорейского производителя биосимиляров Celltrion www.celltrion.com/en/biosimilar/generic.doприводится информация, что невозможно создать точную копию биологического препарата, и в конечных продуктах есть отличия ввиду разных условий культивирования клеток и методов очистки. Тем самым, производитель биосимиляров подтверждает, что произвести полностью идентичный оригинальному препарату биосимиляр невозможно.
Важно отметить, что биоподобие не означает автоматической взаимозаменяемости. Для подтверждения взаимозаменяемости с позиции доказательной медицины необходимо в рамках проведения рандомизированных контролируемых клинических исследований доказать, что именно многократное переключение с одного биологического препарата на биосимиляр и обратно (несколько переключений) не несет дополнительных краткосрочных и долгосрочных рисков для пациентов в виде снижения эффективности, дополнительных побочных эффектов, повышения иммуногенности. И именно достоверная оценка эффективности и безопасности лечения при многократном переключении является необходимым требованием для принятия решений о возможности автоматической замены. Это относится также при переключении с одного биосимиляра на другой.
Практика международных регуляторных органов
Основными международными регуляторными органами являются Всемирная организация здравоохранения (ВОЗ), Европейское агентство по лекарственным средствам (EMA), Агентство по управлению за обращением лекарственных средств и пищевых продуктов США (FDA).
ВОЗ занимается вопросами разработки дифференцированного подхода к биологическим препаратам. Впервые в 1991 г. введены греческие буквы в МНН, обозначающие, что различные варианты гликопротеина имеют разные МНН. Греческая буква присваивается в алфавитном порядке для обозначения того, что профиль гликоформы может отличаться качественно и/или количественно. В последние 5 лет активно обсуждается вопрос введения биологических классификаторов. Эксперты ВОЗ рассматривают различные варианты и предложения о необходимости присвоения уникального 4-буквенного кода из согласных букв, построенного автоматически. Возможно, к ним будут добавлять и числовые значения. Это и есть биологический классификатор, который позволит дифференцировать БП. Классификатор может служить эффективным инструментом для регуляторов разных стран мира. ВОЗ пока еще не выпустила финальный документ, но он в процессе подготовки. Это, безусловно, важный шаг, который позволит улучшить систему фармаконадзора.
EMA зарегистрировала более 20 различных биосимиляров, а FDA всего 4. Оба регуляторных агентства подтверждают эффективность и безопасность зарегистрированных биосимиляров, однако в то же время подчеркивают, что регистрация и подобие препаратов не означает, что при лечении пациентов они являются автоматически взаимозаменяемыми. С позиции доказательной медицины взаимозаменяемость требует бОльших доказательств, чем биоподобие. Замена оригинального препарата на биосимиляр сопряжена с рисками для безопасности пациентов и поэтомузарегистрированные на сегодняшний день биосимиляры не являются взаимозаменяемыми со своими оригинальными аналогами. На сайте FDA указано, что биосимиляры зарегистрированы, но при этом они НЕ являются взаимозаменяемыми препаратами с референтными.
В США есть так называемая Оранжевая книга, включающая определенный перечень взаимозаменяемых препаратов. Эти записи носят рекомендательный характер и в этот перечень НЕ входят биотехнологические препараты. Буквально несколько месяцев назад FDA выпустило предварительный вариант рекомендаций по взаимозаменяемости, который вынесен на обсуждение. В нем говорится о том, что необходимо доказать в исследованиях безопасность переключения на биосимиляр и обратно при строгом контроле и мониторинге. Повторять данное переключение необходимо 2 раза и более.
EMA проводит оценку лекарственного средства только в целях регистрации. Оценка Агентства не включает рекомендации о том, являются ли биосимиляры взаимозаменяемыми с оригинальным препаратом. Вопросы, касающиеся переключения с одного биологического препарата на другой, должны решаться на национальном уровне стран ЕС и при взаимодействии пациента, врача и фармацевта. При назначении биологических ЛС должны учитываться требования ЕМА по фармаконадзору.
Последнее обновленное руководство по надлежащей практике фармаконадзора обязывает медицинских работников указывать торговое наименование и номер серии назначенного/использованного биологического ЛС или биосимиляра в медицинской документации пациентов. Кроме того, пациенты должны быть информированы о торговом наименовании и номере серии назначенного им биологического ЛС или биосимиляра. Это особенно важно в тех случаях, когда разные версии одного и того же действующего вещества доступны на рынке одновременно и могут быть назначены одному и тому же пациенту поочередно.
Следует обратить внимание на позицию FDA, пожалуй, наиболее авторитетного регуляторного агентства в мире. Она заключается в том, что МНН биосимиляров и оригинальных биологических препаратов должны отличаться!
На официальном сайте FDA при поиске зарегистрированных биосимиляров можно увидеть, что у оригинального препарата в графе МНН – указано собственно МНН, а у биосимиляра к МНН добавлен 4-хбуквенный классификатор, являющийся идентификатором того, что это разные биологические препараты. Эта информация важна для медицинской общественности и находится в открытом доступе. Это является обязательным требованием и необходимо для:
- возможности идентификации препарата со стороны пациента, врача и фармацевта;
- усиленного мониторинга препарата со стороны фармаконадзора;
- снижения рисков по использованию биосимиляра в незарегистрированном показании;
- недопущения автоматического переключения между биосимилярами и биологическими препаратами.
Таким образом, при назначении данных препаратов появляется возможность идентифицировать их, т.е. отслеживать возможные побочные действия, эффективность и безопасность терапии.
Международный опыт некоторых стран-участниц ОЭСР
В таких странах, как Израиль, Италия, Австралия, Испания не разрешается автоматическая замена одного биологического препарата на другой. Такое решение может быть принято только врачом. В большинстве стран ОЭСР по данным официальных сайтов регуляторных агентств позиция выражается в следующем:
- при эффективности и безопасности лечения рекомендуется продолжать лечение одним биологическим препаратом, исключая автоматическое переключение с одного препарата на другой на уровне аптеки;
- решение о замене препарата применяется только врачом в каждом конкретном случае с учетом клинической ситуации, что соответствует принципам пациентоориентированности.
В США, Японии, Австралии уже внедрено использование префиксов, суффиксов или отдельных идентификаторов для БП и это является международно-признанной и оправданной процедурой и, на наш взгляд, является самым оптимальным решением для внедрения в остальных странах.
Текущая ситуация в Республике Казахстан
Министерство здравоохранения Республики Казахстан проводит значительные реформы системы здравоохранения и лекарственного обеспечения, среди которых, внедрение принципов доказательной медицины, совершенствование формулярной системы, введение референтного ценообразования. Национальный центр экспертизы лекарственных средств в соответствии с лучшими мировыми практиками усовершенствовал работу системы фармаконадозара, систему оценки безопасности препаратов путем декларирования.
Данные меры в комплексе позволяют сократить операционные расходы компаний и сроки проведения оценки безопасности препаратов, обеспечивают рациональное использование бюджетных средств, увеличивают доступность лекарственных препаратов и повышают охват пациентов терапией.
Вместе с тем, с течением времени и появлением новых биологических лекарственных средств и биосимиляров требуется дальнейшее развитие и совершенствование законодательства в области обращения биологических препаратов. Актуальность этого направления к настоящему времени очень возросла. При выборе терапии первостепенным приоритетом является обеспечение эффективности и безопасности лечения и предотвращения нежелательных явлений. Во главе угла при назначении ЛС должен быть пациент и его здоровье
В настоящее время в Республике Казахстан нет биологических классификаторов в списках ГОБМП и государственном реестре для возможной идентификации БП, что потенциально может привести к автоматической замене одного препарата другим без учета принципа пациентоориентированного лечения и невозможности отслеживать нежелательные явления и проводить оценку причинно-следственной связи их возникновения.
Назрела необходимость на этапе регистрации биосимиляров в инструкции в разделе «МНН» указывать биологический классификатор (уникальный код) по примеру международных регуляторов (FDA, ВОЗ) и при включении в списки ГОБМП также ввести разделение.
У специалистов здравоохранения сейчас ограничен выбор препарата – они могут использовать только те биологические препараты, которые закупаются. Но при этом юридическая ответственность за результаты оказания медицинской помощи пациентам полностью лежит на враче. Организация закупа биологических ЛС должна производиться с указанием идентификации каждого БП (номер РУ или другие способы) в целях исключения автоматической, неконтролируемой замены и предоставления врачу права выбора препарата при лечении пациента путем разделения биологических препаратов и всех биосимиляров в отдельные строки в списках ГОБМП. Иначе, пациенты, получавшие ранее лечение одним биологическим препаратом, по результатам закупа могут получать совершенно другой биотехнологический препарат с подобным МНН, что может привести:
1) к невозможности отслеживать нежелательные явления и проводить оценку причинно-следственной связи их возникновения;
2) к увеличению риска формирования антител;
3) к развитию дополнительных иммунологических реакций;
4) к снижению эффективности лечения и дополнительным затратам.
К сожалению, в нашей стране сохраняется возможность регистрации тех биосимиляров, которые отсутствуют на рынке стран ОЭСР, США, ЕС, а зарегистрированы только в стране-производителе. Бывает так, что эти препараты не прошли подтверждение регистрации в ЕС. С учетом того, что мы стремимся в 30-ку развитых стран, возникает вопрос: «А насколько целесообразно допускать регистрацию препаратов биологического происхождения, которые не прошли регистрацию в ЕС?» В настоящее время это, конечно, обосновано и юридических оснований отказывать в регистрации таким препаратам нет. Но это серьезный вопрос, требующий обсуждения, и хочется верить, что в будущем в законодательство будут внесены соответствующие изменения, так как речь идет о здоровье граждан, где лучше не допускать компромиссов.
Нужно отметить, что даже ведущие регуляторы мира еще не решили все краеугольные вопросы, касающиеся взаимозаменяемости. Они рекомендуют разные МНН для биологических препаратов и биосимиляров, введение классификаторов. Эти и другие факты указывают на недостаточную изученность данного вопроса, а это означает, что необходимо очень аккуратно подходить к автоматическим заменам биологических препаратов и исходить не из интересов бизнеса и индустрии здоровья, а прежде всего из интересов пациентов. Приемлемым шагом на данном этапе видится возможность накопления локального опыта применения биосимиляров у пациентов, ранее не получавших биологическую терапию, а пациентам, уже получающим терапию, можно продолжать лечение ранее назначенным препаратом. Для этого и необходимо разделение биологических препаратов и биосимиляров в отдельные строки в списках ГОБМП.
Доклад отражает личное мнение и взгляды автора, основан на информации из научных источников и официальных сайтов регуляторных органов. Озвучен на конференции «Фармаконадзор лекарственных средств и мониторинг безопасности медицинских изделий. Регистрация и экспертиза лекарственных средств и медицинских изделий в рамках ЕАЭС» г. Алматы, апрель, 2017.
Любая форма копирования данного информационного материала, его публикация или частичное воспроизводство разрешается только при условии наличия гиперссылки/ссылки на сайт информационно-аналитического издания "Фармацевтическое обозрение Казахстана" - http://pharm.reviews или https://pharmreview.kz.











